Ligação metálica é uma ligação química de átomos caracterizada normalmente por um subnível eletrônico d completo e um s incompleto pelo qual os elétrons fluem livremente através de uma estrutura cristalina definida. Em relação às condições normais de temperatura e pressão, a ligação metálica confere a substância um alto ponto de fusão e vaporização e usualmente apresenta uma densidade superior a outras ligações químicas. Tal ligação também fornece outras propriedades tais como maleabilidade, ductibilidade, brilho e alta condutividade elétrica mesmo quando no estado líquido.
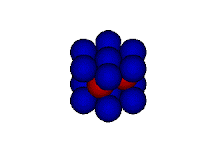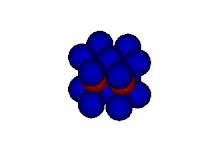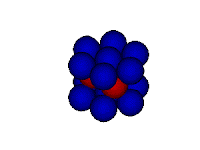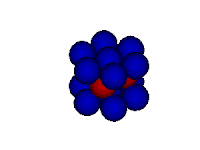
Modelo do mar de elétrons
Neste modelo o metal é retratado como uma rede de cátions metálicos imersos em um "mar" de elétrons de valência. Os elétrons encontram-se confinados ao metal por meio de atrações eletrostáticas aos cátions e distribuídos uniformemente ao longo da estrutura metálica. Mas apesar de presos à estrutura metálica, os elétrons possuem mobilidade por nenhum elétron estar vinculado a um cátion específico.
Ao expor o metal a uma diferença de potencial elétrico (ddp ou tensão elétrica), os elétrons fluem pelo metal no sentido do polo positivo para o metal a partir do polo negativo.
A condução térmica também pode ser explicada pela mobilidade dos elétrons, através da rápida transmissão de energia cinética pelo sólido.
A explicação deste modelo para a maleabilidade e ductibilidade dos metais vem do fato de os átomos metálicos formarem ligações com muitos vizinhos. A redistribuição dos elétrons acomoda parcialmente os átomos em suas novas posições.
Entretanto, este modelo não explica satisfatoriamente todas as propriedades dos metais. Um exemplo é a força de ligação entre os átomos metálicos que por este modelo deveria aumentar à medida que o número de elétrons de valência aumenta, resultando em um aumento dos pontos de fusão.
Mas os metais do grupo 6 (Cromo, Molibdênio e Tungstênio), que ocupam o centro dos metais de transição tem os maiores pontos de fusão em seus respectivos períodos. Eventos similares ocorrem ao se analisar calor de fusão, dureza e ponto de ebulição.
Ao buscar uma melhor explicação para estes fatos descritos anteriormente, é necessário conhecer o modelo da Teoria de bandas que contém uma abordagem da ligação metálica a partir da Teoria dos orbitais moleculares.
Modelo da Teoria de bandas
Os elétrons de cada átomo em um sólido estão sujeitos à interação com os átomos vizinhos. Ao aproximarmos um átomo isolado a outros, os níveis de energia de cada um são perturbados levemente pela presença do vizinho pois o Princípio de exclusão de Pauli não permite que ocupem níveis de energia iguais. Se aproximarmos um grande número de átomos, teremos um grande número de níveis de energia próximos uns dos outros, formando uma "banda de energia" quase contínua no lugar dos discretos níveis de energia que os átomos teriam individualmente.
CÉLULAS UNITÁRIAS - ESTRUTURAS CRISTALINAS
LIGAS METÁLICAS (FORÇAS INTERATÔMICAS ENTRE METAIS DIFERENTES)